КВАНТОВАЯ ФИЗИКА
Корпускулярно-волновой дуализм
Корпускулярно-волновой дуализм — важное универсальное свойство природы, которое состоит в том, что каждому микрообъекту присущи сразу и корпускулярные, и волновые характеристики.
Согласно этой теории свет можно рассматривать и как волну и как поток частиц или как поток волновых частиц — квантов. Кванты света называют еще фотонами. Причем энергия фотона согласно уравнению планка напрямую зависит от частоты
![]()
где ![]() постоянная Планка — коэффициент пропорциональности связывающий энергию кванта, с его частотой.
постоянная Планка — коэффициент пропорциональности связывающий энергию кванта, с его частотой. ![]() Дж⋅с
Дж⋅с
Энергию фотона так же можно выразить через длину волны ![]() и скорость света
и скорость света ![]() импульс
импульс ![]()
![]()
Импульс фотона:
![]()
Фотоэффект
Фотоэффект — это выбивание электронов из вещества падающим светом.
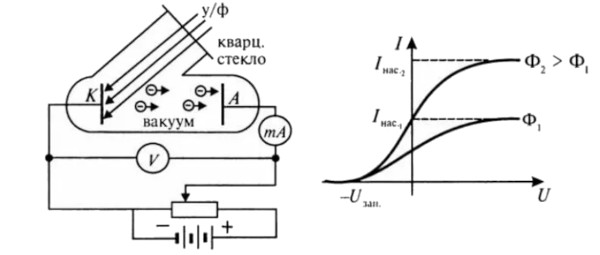
Первый закон фотоэффекта: фототок насыщения — максимальное число фотоэлектронов, вырываемых из вещества за единицу времени, — прямо пропорционален интенсивности падающего излучения.
Второй закон фотоэффекта: максимальная кинетическая энергия фотоэлектронов не зависит от интенсивности падающего излучения и линейно возрастает с увеличением частоты падающего излучения.
Третий закон фотоэффекта: для каждого вещества существует граничная частота такая, что излучение меньшей частоты не вызывает фотоэффекта, какой бы ни была интенсивность падающего излучения. Эта минимальная частота излучения называется красной границей фотоэффекта.
![]()
Энергия фотона ![]() идет на совершение работы
идет на совершение работы ![]() (работы выхода), по вырыванию электрона из вещества, и придание этому электрону кинетической энергии
(работы выхода), по вырыванию электрона из вещества, и придание этому электрону кинетической энергии ![]() .
.
Красная граница фотоэффекта — это минимальная частота, или соответствующая длинна волны, при которой начинается фотоэффект.
Запирающее напряжение ![]() ― это напряжение, не позволяющее электронам покинуть фотокатод. Если напряжение в цепи больше или равно запирающему напряжению, то электроны не могут достигнуть анода: даже если они покидают ненадолго фотокатод, сила электрического поля возвращает их в металл ― и фототока в цепи нет.
― это напряжение, не позволяющее электронам покинуть фотокатод. Если напряжение в цепи больше или равно запирающему напряжению, то электроны не могут достигнуть анода: даже если они покидают ненадолго фотокатод, сила электрического поля возвращает их в металл ― и фототока в цепи нет.
![]()
где ![]() -заряд фотоэлектрона.
-заряд фотоэлектрона.
Атомная физика
Планетарная модель строения атома Модель строения атома предложенная Эрнестом Резерфордом в 1911 году. Согласно этой модели вокруг положительно заряженного ядра, обладающего почти всей массой атома, вращаются отрицательно заряженные электроны, — подобно тому, как планеты движутся вокруг Солнца.
Постулаты Бора.
- Постулат стационарных состояний: каждому из стационарных (квантовых) состояний, в котором находится атомная система, соответствует определенный уровень энергии Е. Находясь в стационарном состоянии, атом не излучает.
- Правило частот: переход атома из одного квантового состояния, характеризующегося энергией En в новое квантовое состояние, которое характеризуется энергией Em, происходит излучение или поглощение кванта энергии. Энергия кванта при этом определяется как разность энергий двух квантовых состояний:
![]()
Проще говоря, электрон будет находится на том, или ином энергетическом уровне, а его переходы между этими уровнями будут сопровождаться поглощением или излучением кванта энергии.
Ядерная физика
Атомное ядро — это центральная часть атома, состоящая из протонов и нейтронов (которые вместе называются нуклонами).
Протон — положительно заряженная частица, заряд которой по модулю равен заряду электрона ![]() Кл. Масса протона в 1836 раз больше массы электрона. Масса покоя протона
Кл. Масса протона в 1836 раз больше массы электрона. Масса покоя протона ![]() кг =
кг = ![]() а.е.м.
а.е.м.
Нейтрон — это элементарная частица, не имеющая заряда, т.е. нейтральная. Масса нейтрона в 1839 раз превышает массу электрона, то есть почти равна (незначительно больше) массе протона. Масса покоя свободного нейтрона
![]() кг =
кг = ![]() а.е.м. и превосходит массу протона на 2.5 массы электрона.
а.е.м. и превосходит массу протона на 2.5 массы электрона.
![]()
Зарядовое число ![]() — количество протонов в ядре атома. Если умножить зарядовое число на заряд протона, мы получим заряд ядра атома:
— количество протонов в ядре атома. Если умножить зарядовое число на заряд протона, мы получим заряд ядра атома:
![]()
Массовое число ![]() — количество нуклонов в ядре атома.
— количество нуклонов в ядре атома.
![]()
где ![]() количество нейтронов в ядре атома.
количество нейтронов в ядре атома.
Изотопы — это разновидности атомов одного и того же химического элемента, атомные ядра которых имеют одинаковое число протонов ![]() и различное число нейтронов
и различное число нейтронов ![]() .
.
Дефект массы — это разница между суммой масс всех нуклонов, содержащихся в ядре, и массой самого ядра ![]() .
.
![]()
Радиоактивность — свойство атомных ядер самопроизвольно (спонтанно) изменять свой состав (заряд ![]() , массовое число
, массовое число ![]() ) путем испускания элементарных частиц или ядерных фрагментов.
) путем испускания элементарных частиц или ядерных фрагментов.
Альфа распад — испускание ядром атома альфа частицы, представляющей собой ядро атома гелия ![]() .
.
![]()
Бета распад — испускание ядром атома бета частицы, представляющей собой электрон или позитрон (при позитронном бета распаде)
![]()
![]()
Гамма лучи — излучение гамма кванта энергии. (при гамма излучении зарядовое и массовое числа ядра атома не меняются).
Закон радиоактивного распада:
![]()
Период полураспада ![]() — время за которое распадается половина радиоактивного вещества.
— время за которое распадается половина радиоактивного вещества.





